- 2021/08/23 掲載
キヤノンITS、製薬企業向け「PVLink Report Manager Cloud」の提供を開始
製薬企業は、医薬品の副作用と疑われる症例を確認した場合、厚生労働省所轄の独立行政法人医薬品医療機器総合機構(以下、PMDA)に報告する義務があります。令和2年度のPMDAに対する医薬品の副作用等報告数は約65万件あり、膨大な症例情報の収集および評価を行う製薬企業の安全管理部門では、業務効率化と負荷軽減のため安全性情報進捗管理システム(※1)の導入ニーズが高まっています。
しかし、症例情報の収集項目は取扱商品ごとに多岐にわたり、個社に合わせて要件定義を行うシステム開発では、導入までに時間がかかることが問題です。また、製薬企業のシステム構築においては、開発プロセスの検証と文書化がガイドライン(※2)として定められており、初期導入時はもちろん、取扱商品の拡大による項目の追加・修正など改修を行うたびに、対応が必要となります。そのため、製薬企業が自社でシステムを開発し、維持管理・運用することは大きな負荷となっています。
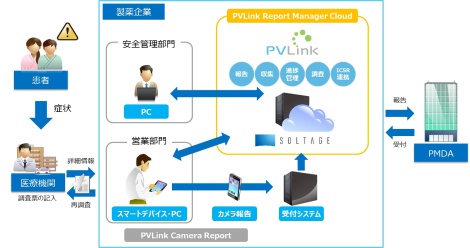
こうした製薬企業の皆さまの課題を解決すべく、キヤノンITSは製薬企業の安全性情報の進捗管理に必要な機能を標準化し、自社クラウドサービス「SOLTAGE(ソルテージ)」(※3)を活用した「PVLink Report Manager Cloud」の提供を開始します(※4)。
「PVLink Report Manager Cloud」は、報告・収集・進捗管理・調査・個別症例安全性報告(以下、ICSR)連携など安全性情報管理業務に必要な機能を一式備えており、要件定義にかかる時間を短縮できるため、短期間での導入が可能です。さらに、標準の収集項目だけでなく、取り扱い薬品に特化した個社特有の収集項目も追加することができ、入力必須指定などきめ細かな設定機能を備えています。また、ガイドラインへの対応はキヤノンITSが行い(※5)、システムの導入から保守サポートまでワンストップで提供し、お客さまの負担を軽減します。
キヤノンITSは、EDIシステム「EDI-Master DEX for Medical」(※6)を製薬企業向けソリューションとして提供しており、これまでPMDAに対する副作用報告の情報を送信する仕組みとして、大手製薬企業で多数の導入実績があります。今後も製薬企業の副作用報告やそれに伴う関連業務についてトータルなソリューションを展開し、製薬企業のお客さまの安全性情報管理業務の運用をサポートしていきます。
※1 MRが医療機関から収集した情報(副作用報告など)をWebで報告し、安全管理部門が進捗管理するシステム
※2 コンピュータ化システムバリデーション(CSV)
厚生労働省:医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドラインについて(https://www.mhlw.go.jp/web/t_doc?dataId=00tb6573&dataType=1&pageNo=1)
※3 キヤノンITSが提供するIaaS型の国産クラウドサービス。
※4 PVLink Report Managerはパッケージ製品(買取型)の提供も可能です。
※5 一部、お客さま自身での作業が必要です。詳細はお問い合わせください。
※6 キヤノンITSが提供する個別症例安全性報告を電子的に伝送する製薬企業に特化したEDIシステム。2021年10月より「EDI-Master B2B for Medical」に名称変更します。
プレスリリースのおすすめコンテンツ
PR
PR
PR